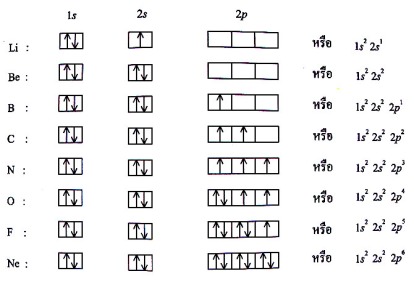
4) การบรรจุเต็ม (filled configuration) เป็นการบรรจุอิเล็กตรอนในออร์บิทัลที่มีระดับพลังงานเท่ากัน แบบเต็ม ครบ 2 ตัว ส่วนการบรรจุครึ่ง (half- filled configuration) เป็นการบรรจุอิเล็กตรอนลงในออร์บิทัลแบบครึ่งหรือเพียง 1 ตัว เท่านั้น ซึ่งการบรรจุทั้งสองแบบ (ของเวเลนซ์อิเล็กตรอน) จะทำให้มีความเสถียรมากกว่าตัวอย่างการบรรจุเต็ม เช่น

2.4 ตารางธาตุและสมบัติของธาตุหมู่หลัก
ตารางธาตุ (Periodic table of elements) คือ ตารางที่นักวิทยาศาสตร์ได้รวบรวมธาตุต่างๆ ไว้เป็นหมวดหมู่ตามลักษณะ และคุณสมบัติที่เหมือนกัน เพื่อเป็นประโยชน์ในการศึกษาในแต่ละส่วนของตารางธาตุ โดยคาบ ( Period ) เป็นการจัดแถวของธาตุแนวราบ ส่วนหมู่ ( Group ) เป็นการจัดแถวของธาตุในแนวดิ่ง ซึ่งมีรายละเอียดดังต่อไปนี้
- ธาตุหมู่หลัก มีทั้งหมด 8 หมู่ 7 คาบ โดยธาตุที่อยู่ด้านซ้ายของเส้นขั้นบันได จะเป็นโลหะ (Metal) ส่วนทางด้านขวาเป็นอโลหะ (Non metal) ส่วนธาตุที่อยู่ติดกับเส้นขั้นบันไดนั้น จะเป็นกึ่งโลหะ (Metalloid)
- ธาตุทรานซิชัน มีทั้งหมด 8 หมู่ แต่หมู่ 8 มีทั้งหมด 3 หมู่ย่อย จึงมีธาตุต่างๆ รวม 10 หมู่ และมีทั้งหมด 4 คาบ
ธาตุอินเนอร์ทรานซิชัน มี 2คาบโดยมีชื่อเฉพาะเรียกคาบแรกว่าคาบแลนทาไนด์ - (Lanthanide series) และเรียกคาบที่สองว่า คาบแอกทิไนด์ (Actinide series) เพราะเป็นคาบที่อยู่ต่อมาจาก 57La (Lanthanum) และ 89Ac (Actinium) ตามลำดับ คาบละ 14 ตัวรวมเป็น 28 ตัว
การจัดเรียงธาตุลงในตารางธาตุ
เมื่อทราบการจัดเรียงอิเล็กตรอนของธาตุต่างๆ แล้ว จะเห็นว่าสามารถจัดกลุ่มธาตุได้ง่ายขึ้น โดยธาตุที่มีระดับพลังงานเท่ากัน ก็จะถูกจัดอยู่ในคาบเดียวกัน ส่วนธาตุที่มีจำนวนอิเล็กตรอนในระดับพลังงานนอกสุดเท่ากัน ก็จะถูกจัดอยู่ในหมู่เดียวกัน ดังภาพ

ภาพการจัดเรียงธาตุลงในตารางธาตุ
ประเภทของธาตุในตารางธาตุ
ธาตุโลหะ (metal) โลหะทรานซิชันเป็นต้นฉบับของโลหะ ธาตุโลหะเป็นธาตุที่มีสถานะเป็นของแข็ง ( ยกเว้นปรอท ที่เป็นของเหลว) มีผิวที่มันวาว นำความร้อน และไฟฟ้าได้ดี มีจุดเดือดและจุดหลอมเหลวสูง ( ช่วงอุณหภูมิระหว่างจุดหลอมเหลวกับจุดเดือดจะต่างกันมาก) ได้แก่ โซเดียม (Na) เหล็ก (Fe) แคลเซียม (Ca) ปรอท (Hg) อะลูมิเนียม (Al) แมกนีเซียม (Mg) สังกะสี (Zn) ดีบุก (Sn) เป็นต้น
ธาตุอโลหะ ( Non metal ) มีได้ทั้งสามสถานะ สมบัติส่วนใหญ่จะตรงข้ามกับอโลหะ เช่น ผิวไม่มันวาว ไม่นำไฟฟ้า ไม่นำความร้อน จุดเดือดและจุดหลอมเหลวต่ำ เป็นต้น ได้แก่ คาร์บอน( C ) ฟอสฟอรัส (P) กำมะถัน (S) โบรมีน (Br) ออกซิเจน (O 2) คลอรีน (Cl 2) ฟลูออรีน (F 2) เป็นต้น
ธาตุกึ่งโลหะ (metalloid) เป็นธาตุกึ่งตัวนำ คือ มันจะสามารถนำไฟฟ้าได้เฉพาะในภาวะหนึ่งเท่านั้น ธาตุกึ่งโลหะเหล่านี้จะอยู่บริเวณเส้นขั้นบันได ได้แก่ โบรอน (B) ซิลิคอน ( Si) เป็นต้น
ธาตุกัมมันตรังสี เป็นธาตุที่มีส่วนประกอบของ นิวตรอน กับโปรตอน ไม่เหมาะสม (>1.5) ธาตุที่ 83ขึ้นไปเป็นธาตุกัมมันตภาพรังสีทุกไอโซโทปมีครึ่งชีวิต
สมบัติของธาตุในแต่ละหมู่
ธาตุหมู่ I A หรือโลหะอัลคาไล (alkaline metal)
- โลหะอัลคาไล ได้แก่ ลิเทียม โซเดียม โพแทสเซียม รูบิเดียม ซีเซียม และแฟรนเซียม
- เป็นโลหะอ่อน ใช้มีดตัดได้
- เป็นหมู่โลหะมีความว่องไวต่อการเกิดปฏิกิริยามากที่สุด สามารถทำปฏิกิริยากับออกซิเจนในอากาศ จึงต้องเก็บไว้ในน้ำมัน
-ออกไซด์และไฮดรอกไซด์ของโลหะอัลคาไลละลายน้ำได้สารละลายเบสแก่
- เมื่อเป็นไอออน จะมีประจุบวก
- มีจุดเดือดและจุดหลอมเหลวต่ำ มีความหนาแน่นต่ำเมื่อเทียบกับโลหะอื่นๆ
- มีเวเลนซ์อิเล็กตรอน = 1
ธาตุหมู่ II A หรือโลหะอัลคาไลน์เอิร์ธ (alkaline earth)
- โลหะอัลคาไลน์เอิร์ธ ได้แก่ เบริลเลียม แมกนีเซียม แคลเซียม สตรอนเชียม แบเรียม เรเดียม
- มีความว่องไวต่อการเกิดปฏิกิริยามาก แต่น้อยกว่าโลหะอัลคาไล
- ทำปฏิกิริยากับน้ำได้สารละลายเบส สารประกอบโลหะอัลคาไลน์เอิร์ธพบมากในธรรมชาติ
- โลหะอัลคาไลน์เอิร์ธมีความว่องไวแต่ยังน้อยกว่าโลหะอัลคาไล
- โลหะอัลคาไลน์เอิร์ธมีเวเลนซ์อิเล็กตรอน = 2
ธาตุหมู่ III
- ธาตุหมู่ III ได้แก่ B Al Ga In Tl
- มีเวเลนซ์อิเล็กตรอน = 3
ธาตุหมู่ IV
- ธาตุหมู่ IV ได้แก่ C Si Ge Sn Pb
- มีเวเลนซ์อิเล็กตรอน = 4
ธาตุหมู่ V
- ธาตุหมู่ V ได้แก่ N P As Sb Bi
- มีเวเลนซ์อิเล็กตรอน = 5
ธาตุหมู่ VI
- ธาตุหมู่ VI ได้แก่ O S Se Te Po
- มีเวเลนซ์อิเล็กตรอน = 6
ธาตุหมู่ VII หรือหมู่แฮโลเจน (Halogen group)
- หมู่ธาตุแฮโลเจน ได้แก่ ฟลูออรีน คลอรีน โบรมีน ไอโอดีน และแอสทาทีน
- เป็นหมู่อโลหะที่ว่องไวต่อการเกิดปฏิกิริยามากที่สุด (F ว่องไวต่อการเกิดปฏิกิริยามากที่สุด)
- เป็นธาตุที่มีพิษทุกธาตุและมีกลิ่นแรง
- โมเลกุลของธาตุแฮโลเจนประกอบด้วย 2 อะตอม (Cl 2 Br 2 I 2)
- แฮโลเจนไอออนมีประจุบลบหนึ่ง (F - C - Br - I - At -)
ธาตุหมู่ VIII หรือก๊าซเฉื่อย หรือก๊าซมีตระกูล (Inert gas )
- ก๊าซมีตระกูล ได้แก่ ฮีเลียม นีออน อาร์กอน คริปทอน ซีนอน และเรดอน
- มีเวเลนซ์อิเล็กตรอนเต็ม 8 อิเล็กตรอน จึงทำให้เป็นก๊าซที่ไม่ว่องไวต่อการเกิดปฏิกิริยา
- ก๊าซมีตระกูลอยู่เป็นอะตอมเดี่ยว แต่ยกเว้น Kr กับ Xe ที่สามารถสร้างพันธะได้
ขนาดอะตอมของธาตุ
หน่วยพิโกเมตร

ขนาดอะตอมของธาตุต่างๆ
ขนาดของอะตอมนั้นถ้าจะพิจารณาถึงปัจจัยต่างๆ ที่ส่งผลกระทบต่อขนาดของอะตอมนั้น อาจแบ่งแยกออกได้เป็นข้อ เรียงตามลำดับความสำคัญได้ดังนี้
1. จำนวนระดับพลังงาน
2. จำนวนโปรตอน
3. จำนวนอิเล็กตรอน
ขนาดไอออนของธาตุ

หน่วยพิโกเมตร
สมบัติอื่นๆ ของธาตุ
พลังงานไอโอไนเซชัน (Ionization Energy : IE) หมายถึง พลังงานปริมาณน้อยที่สุด ที่ทำให้อิเล็กตรอนหลุดจากอะตอม ในสถานะก๊าซ เช่น
ธาตุที่มีอิเล็กตรอนมากกว่า 1 ตัว เช่น ธาตุลิเทียม(Li)
Li(g)  Li +(g) + e - IE 1 = 520 kJ/mol
Li +(g) + e - IE 1 = 520 kJ/mol
Li +(g)  Li 2+(g) + e - IE 2 = 7,394 kJ/mol
Li 2+(g) + e - IE 2 = 7,394 kJ/mol
Li 2+(g)  Li 3+(g) + e - IE 3 = 11,815 kJ/mol
Li 3+(g) + e - IE 3 = 11,815 kJ/mol
จากการสังเกตจากค่าพลังงานไอออไนเซชันจะพบว่า IE 1 คือพลังงานที่ให้แก่อะตอมเพื่อดึงอิเล็กตรอนที่อยู่วงนอกสุดมีค่าน้อยที่สุด เพราะอิเล็กตรอนที่อยู่ห่างจากนิวเคลียสหลุดออกได้ง่าย
อิเล็กโทรเนกาติวิตี (Electronegativity : EN) หมายถึง ความสามารถในการดึงดูดอิเล็กตรอนในพันธะเข้ามาหาตัวเอง
Na + -------> Cl -
จากภาพจะเห็นว่า อะตอมของ Cl มีความสามารถในการดึงดูดอิเล็กตรอนเข้าหาตัวเองได้ดีกว่า Na แสดงว่า Cl มีค่าอิเล็กโทรเนกาติวิตีสูงกว่า Na
สัมพรรคภาพอิเล็กตรอน ( Electron Affinity : EA ) คือ พลังงานที่อะตอมในสถานะก๊าซคายออกมาเมื่อได้รับอิเล็กตรอน สมการเป็นดังนี้
F(g) + e -  Li -(g) + พลังงาน EA = -333 kJ/mol
Li -(g) + พลังงาน EA = -333 kJ/mol


2.5 ธาตุทรานซิซัน
ธาตุแทรนซิชัน คือ กลุ่มธาตุที่อยู่ระหว่างหมู่ IIA กับ IIIA ซึ่งก็คือธาตุหมู่ B ทั้งหมด ประกอบด้วยหมู่ IB – VIIIB รวมทั้ง อินเนอร์แทรนซิชัน ได้แก่ กลุ่มแลนทาไนด์ และกลุ่มแอกทิไนต์
ธาตุแทรนซิชัน เป็นธาตุที่ใช้อิเล็กตรอนในระดับพลังงานย่อย ในการเกิดพันธะ ยกเว้นธาตุหมู่ 2B ที่ใช้อิเล็กตรอนในระดับพลังงานย่อย s ในการเกิดพันธะ
ธาตุแทรนซิชันในคาบที่ 4 ได้แก่ Sc , Ti , V , Cr , Mn , Fe , Co , Ni , Cu , Zn
สารประกอบของธาตุแทรนซิชัน
ธาตุแทรนซิชันสามารถทำปฏิกิริยาเกิดสารประกอบต่าง ๆ ได้หลายชนิด เนื่องจากธาตุแทรนซิชันมีค่าเลขออกซิเดชันหลายค่า และให้สีของสารประกอบแตกต่างกัน เช่น MnO2 มีสีดำ ,KMnO4 มีสีม่วงแดง และ K2MnO4 มีสีเขียว
และโดยทั่วไปธาตุแทรนซิชันสามารถเกิดสารประกอบเชิงซ้อน และไอออนเชิงซ้อนได้
สารประกอบของธาตุแทรนซิชันแบ่งได้ 2 ประเภท คือ
1. สารประกอบไอออนิก (ionic compounds)
ไอออนบวกของโลหะแทรนซิชัน + อโลหะไอออนลบหรือกลุ่มไอออนลบ
เช่น CuSO4 คอปเปอร์ (II) ซัลเฟต
FeCl2 ไอร์ออน (II) คลอไรด์
Fe2O3 ไอร์ออน (III) ออกไซด์
2. สารประกอบเชิงซ้อน (complex compounds) คือ สารประกอบที่มีไอออนเชิงซ้อนเป็นองค์ประกอบ มีลักษณะดังนี้
ไอออนเชิงซ้อนบวก + ไอออนลบ
หรือ ไอออนบวก + ไอออนเชิงซ้อนลบ
หรือ ไอออนเชิงซ้อนบวก + ไอออนเชิงซ้อนลบ
เช่น KMnO4 หรือ K+ [MnO4] –
ไอออนบวก + ไอออนเชิงซ้อนลบ = สารประกอบเชิงซ้อน
ไอออนเชิงซ้อน ประกอบด้วยอะตอมหรือไอออนของโลหะแทรนซิชันทำหน้าที่เป็นธาตุอะตอมกลาง (central atom) โดยมีกลุ่มของไอออนหรือโมเลกุลที่เรียกว่า ลิแกนด์ (ligand) มาล้อมรอบอะตอมกลางด้วยพันธะโคออร์ดิเนตโคเวเลนต์
O -
Mn
O O O
สารประกอบเชิงซ้อนของธาตุแทรนซิชัน
* โลหะแทรนซิชันมีโครงสร้างทางอิเล็กตรอนที่แตกต่างไปจากโลหะหมู่ที่ IA และหมู่ IIA คือสามารถรวมกับไอออน หรือหมู่ไอออน โมเลกุลหรือสารบางชนิดที่มีอิเล็กตรอนคู่ว่างอยู่ เกิดเป็นสารประกอบโคเวเลนต์ที่เรียกว่า สารประกอบโคออดิเนชันหรือสารประกอบเชิงซ้อน (Complex Compound)
สารประกอบเชิงซ้อน คือ สารประกอบที่มีไอออนเชิงซ้อนเป็นองค์ประกอบอยู่ด้วย ส่วนมากเกิดกับ ธาตุแทรนซิชัน ไอออนเชิงซ้อน คือ สารที่เกิดจากไอออนลบ (anions) หรือโมเลกุลที่เป็นกลางไม่มีประจุจำนวนหนึ่ง หรือมากกว่านั้นมาสร้างพันธะเคมีกับไอออนกลางของโลหะ เช่น Cu(NH3)42+, ไอออนเชิงซ้อนมี 2 ชนิดคือ ไอออนเชิงซ้อนที่เป็นไอออนบวก และไอออนลบ

อะตอมกลางหรือไอออนกลาง (Central atom ion) คือ อะตอมของธาตุที่อยู่แกนกลางของสารเชิงซ้อน ส่วนมาก ได้แก่ โลหะแทรนซิชัน
ลิแกนด์ คือ ไอออนหรือโมเลกุลที่ล้อมรอบอะตอมกลางหรือไอออนกลาง สารพวกนี้เป็นสารที่มีอะตอมของธาตุที่มีอิเล็กตรอนคู่อิสระอยู่ เช่น F-, Br-, OH-, SCN-, S2-,CO, NH3, H2O เป็นต้น
พันธะระหว่างลิแกนด์ และโลหะแทรนซิชันที่อยู่กลางในสารเชิงซ้อนเป็นพันธะโคเวเลนต์ และจำนวนลิแกนด์ที่ล้อมรอบโลหะแทรนซิชันที่อยู่กลาง เรียกว่า เลขโคออร์ดิเนชัน และเลขโคออร์ดิเนชันเป็นเท่าใดนั้นขึ้นอยู่กับชนิดของธาตุแทรนซิชัน เลขออกซิเดชันของโลหะแทรนซิชัน และชนิดของลิแกนด์ด้วย
สรุปได้ว่า
1. ธาตุแทรนซิชันทุกธาตุเป็นโลหะ มีจุดเดือดและจุดหลอมเหลวสูงเพราะมีพันธะโลหะ
2. ความหนาแน่นมีแนวโน้มเพิ่มขึ้นเมื่อเลขอะตอมเพิ่มขึ้น
3. มีอิเล็กตรอนวงนอกสุด (valence e-) เท่ากับ 2 ยกเว้น Cr และ Cu เท่ากับ 1
4. อิเล็กตรอนถัดจากวงนอกสุดเข้ามาหนึ่งระดับพลังงาน ไม่ครบ 18 ยกเว้น Cu และ Zn
5. มีเลขออกซิเดชันได้มากกว่า 1 ค่า ยกเว้นหมู่ 2B (Zn , Cd) เป็น +2 ค่าเดียว และหมู่ 3B (Sc) 0 เป็น +3 ค่าเดียว
2.6 ธาตุกัมมันตรังสี
ธาตุกัมมันตรังสี หมายถึง ธาตุที่แผ่รังสีได้ เนื่องจากนิวเคลียสของอะตอมไม่เสถียร เป็นธาตุที่มีเลขอะตอม
สูงกว่า 82 กัมมันตภาพรังสี หมายถึง ปรากฏการณ์ที่ธาตุแผ่รังสีได้เองอย่างต่อเนื่อง รังสีที่ได้จากการสลายตัว มี 3 ชนิด คือ รังสีแอลฟา รังสีบีตา และรังสีแกมมา
การแผ่รังสีจะทําให้เกิดธาตุใหม่ได้หรืออาจเป็นธาตุเดิมแต่จํานวนโปรตอนหรือนิวตรอนอาจไม่เท่ากับธาตุ
เดิม และธาตุกัมมันตรังสีแต่ละธาตุ มีระยะเวลาในการสลายตัวแตกต่างกันและแผ่รังสีได้แตกต่างกัน เรียกว่า
ครึ่งชีวิตของธาตุ โดยครึ่งชีวิตเป็นสมบัติเฉพาะตัวของแต่ละไอโซโทปและสามารถใช้เปรียบเทียบอัตราการ
สลายตัวของธาตุกัมมันตรังสีแต่ละชนิดได้ตัวอย่างเช่น ไอโอดีน-131 มีครึ่งอายุ 8 วัน เมื่อนํามาเก็บเป็นเวลา 40
วัน จะเหลือพลังงานเพียง 3 % เท่านั้น สารบางตัวมีครึ่งอายุค่อนข้างนาน เช่น โคบอลท์-60 มีครึ่งอายุ 5.2 ปี,
ถ้าต้องการให้เหลือพลังงาน 3% ต้องเก็บนานถึง 25 ปีส่วนแร่ซีเซียม-137 มีครึ่งอายุ 30 ปีต้องใช้เวลานานถึง
150 ปีจึงจะเหลือพลังงาน 3%
สารกัมมันตรังสีบางชนิดมีอยู่แล้วตามธรรมชาติ เช่น แร่เรเดียม-226,ยูเรเนียม-238 ฯลฯ แต่ที่มีใช้ใน
วงการแพทย์ปัจจุบันเป็นสารที่มนุษย์ผลิตขึ้น เช่น โคบอลท์-60, ซีเซียม-137, อิริเดียม-192 เป็นต้น
1.รังสีเอกซ์ ถูกค้นพบโดย Conrad Röntgen อย่างบังเอิญเมื่อปี ค.ศ. 1895
2.ยูเรเนียม (Uranium) ค้นพบโดย Becquerel เมื่อปี ค.ศ. 1896 โดยเมื่อเก็บยูเรเนียมไว้กับฟิล์มถ่ายรูป ในที่มิดชิด ฟิล์มจะมีลักษณะ เหมือนถูกแสง จึงสรุปได้ว่าน่าจะมีการแผ่รังสีออกมาจากธาตุยูเรเนียม เขาจึงตั้งชื่อว่า Becquerel Radiation
3.พอโลเนียม (Polonium) ถูกค้นพบและตั้งชื่อโดย มารี กูรี ตามชื่อบ้านเกิด (โปแลนด์) เมื่อปี ค.ศ. 1898 หลังจากการสกัดเอายูเรเนียมออกจาก Pitchblende หมดแล้ว แต่ยังมีการแผ่รังสีอยู่ สรุปได้ว่ามีธาตุอื่นที่แผ่รังสีได้อีกแฝงอยู่ใน Pitchblende นอกจากนี้ กูรียังได้ตั้งชื่อเรียกธาตุที่แผ่รังสีได้ว่า ธาตุกัมมันตรังสี (Radioactive Element) และเรียกรังสีนี้ว่า กัมมันตภาพรังสี (Radioactivity)
4.เรเดียม (Radium) ถูกตั้งชื่อไว้เมื่อปี ค.ศ. 1898 หลังจากสกัดเอาพอโลเนียมออกจากพิตช์เบลนด์หมดแล้ว พบว่ายังคงมีการแผ่รังสี จึงสรุปว่ามีธาตุอื่นที่แผ่รังสีได้อีกใน Pitchblende ในที่สุดกูรีก็สามารถสกัดเรเดียมออกมาได้จริง ๆ จำนวน 0.1 กรัม ในปี ค.ศ. 1902
1.รังสีแอลฟา (สัญลักษณ์: α) คุณสมบัติ เป็นนิวเคลียสของอะตอมฮีเลียม (4 2He) มี p+ และ n อย่างละ 2 อนุภาค ประจุ +2 เลขมวล 4 อำนาจทะลุทะลวงต่ำ เบี่ยงเบนในสนามไฟฟ้าเข้าหาขั้วลบ
2.รังสีบีตา (สัญลักษณ์: β) คุณสมบัติ เหมือน e- อำนาจทะลุทะลวงสูงกว่า α 100 เท่า ความเร็วใกล้เสียง เบี่ยงเบนในสนามไฟฟ้าเข้าหาขั้วบวก
3.รังสีแกมมา (สัญลักษณ์: γ) คุณสมบัติเป็นคลื่นแม่เหล็กไฟฟ้า (Electromagnetic Wave) ที่มีความยาวคลื่นสั้นมากไม่มีประจุและไม่มีมวล อำนาจทะลุทะลวงสูงมาก ไม่เบี่ยงเบนในสนามไฟฟ้า เกิดจากการที่ธาตุแผ่รังสีแอลฟาและแกมมาแล้วยังไม่เสถียร มีพลังงานสูง จึงแผ่เป็นคลื่นแม่เหล็กไฟฟ้าเพื่อลดระดับพลังงาน
2.7 การนำธาตุไปใช้ประโยชน์และผลกระทบต่อสิ่งมีชีวิต
ธาตุโลหะ
ประโยชน์
ทำเป็นเครื่องใช้สอยต่างๆ ชิ้นส่วนของเครื่องจักรกล เครื่องอำนวยความสะดวกต่างๆ โลหะที่พบมากในชีวิตประจำวันได้แก่ เหล็ก อะลูมิเนียม เงิน ทองแดง นิกเกิลโครเมียม ฯลฯ
โทษ
โลหะที่เป็นอันตราย มีดังนี้ ปรอท แคดเมียม และตะกั่ว เนื่องจากโลหะเหล่านี้เมื่อเข้าไปในสิ่งมีชีวิต จะไปรบกวนการทำงานของเซลล์โดย ซึ่งเรียกว่า โลหะหนัก
-ยับยั้งการทำงานของเอนไซม์บางชนิด
-แทนที่โลหะสำคัญของ enzymes ทำให้เอนไซม์ทำงานได้น้อยลงหรือไม่ได้เลย
-และ เปลี่ยนแปลงโครงสร้างของชีวโมเลกุล
ธาตุอโลหะ
ประโยชน์
1.ใช้ทำผ้าทนไฟ ผ้าเบรก กระเบื้องมุงหลังคาวัสดุกันความร้อน
2.ใช้ทำเครื่องประดับ ใช้ในอุตสาหกรรม นาฬิกา และการขัดถู
3.เป็นวัตถุดิบในการผลิตเคมีภัณฑ์ ใช้ในอุตสาหกรรมถลุงแร่ ทำสบู่ สีย้อมปุ๋ย และใช้ฟอกหนัง
4.ใช้ทำปูนซีเมนต์ ปูนปลาสเตอร์ แผ่นยิปซัมบอร์ด ชอล์ก กระดาษ และปุ๋ย
5.ใช้ในการทำเครื่องปั้นดินเผา ถ้วยชาม อิฐ กระเบื้อง กระดาษ ยาง และสี
ธาตุกึ่งโลหะ
ประโยชน์
มีประโยชน์มากในการพัฒนาเทคโนโลยีต่าง ๆ ทางด้านอิเล็กทรอนิกส์ สามารถนำไปใช้เป็นอุปกรณ์อิเล็กทรอนิกส์ขนาดเล็กเพื่อเก็บข้อมูลในคอมพิวเตอร์ เครื่องอำนวยความสะดวก และอุปกรณ์อิเล็กทรอนิกส์สมัยใหม่
1. อะตอมประกอบไปด้วยโปรตอนและอิเล็กตรอนในจำนวนที่เท่า ๆ กัน คือ แบบจำลองอะตอมของใคร
ก. ดอลตัน ข. ทอมสัน ค. รัทเทอร์ฟอร์ด ง. โบร์
2. ข้อใดกล่าวถูกต้อง
ก. ธาตุต่างชนิดกันมีมวลต่างกันหรือมีนิวตรอนต่างกันเรียกว่าไอโซโทป
ข. มวลของอะตอม คือ มวลของโปรตอนกับอิเล็กตรอนในนิวเคลียส
ค. มวลของอะตอม คือ มวลของโปรตอนกับนิวตรอนในนิวเคลียส
ง. เลขอะตอมจะบอกถึงจำนวนโปรตอนและจำนวนนิวตรอนในอะตอม
3. อนุภาคข้อใดที่มีมวลใกล้เคียงกัน
ก.โปรตอน อิเล็กตรอน และนิวตรอน
ข.โปรตอนกับอิเล็กตรอน
ค. นิวครอนกับอิเล็กตรอน
ง. โปรตอนกับนิวตรอน
4. ข้อใดถูกต้องเกี่ยวกับแบบจำลองอะตอมของรัทเทอร์ฟอร์ด
ก. โปรตอนและอิเล็กตรอนรวมกันเป็นนิวเคลียสของอะตอม
ข. นิวเคลียสมีขนาดเล็กมากและมีมวลมาก ภายในประกอบด้วยอนุภาคโปรตอน
ค. นิวเคลียสเป็นกลางทางไฟฟ้าเพราะประจุของโปรตอนกับของอิเล็กตรอนเท่ากัน
ง.อะตอมของธาตุประกอบด้วยอนุภาคโปรตอนและอิเล็กตรอนกระจัดกระจายอยู่ภายในด้วยจำนวนเท่ากัน
5. เลขอะตอมของธาตุ คือข้อใด
ก. จำนวนอิเล็กตรอนในอะตอมของธาตุ
ข. จำนวนโปรตอนในอะตอมของธาตุ
ค. จำนวนนิวครอนในอะตอมของธาตุ
ง. จำนวนโปรตอนกับนิวตรอนในอะตอมของธาตุ
6.ข้อใดกลา่วไดถกต้อง
ก.แบบจำลองอะตอมคืิมโนภาพที่สรา้งขึ้น โดยอาศัยข้อมลูจากการทดลองซึ่ง อาจถูก หรือ ผิดก็ได้
ข. นักวทิยาศาสตร์ที่เสนอแนวคดิว่าอะตอมไม่เล็กที่สุดแต่ยังมีอิเล็กตรอนที่เล็กกว่าคือ ดอลตัน
ค. เมื่อดูตอมด้วยกลอ้งจลุทรรศน์สนามไอออนกำลังขยาย 750,000 เท่า จะมองเห็นอะตอมได้ช้ัดเจน
ก. กและข ข. กและค ค. กขและ ง ง. ก เท่านั้น
7. เราทราบค่ามวลของอิเล็กตรอนได้จากการทดลองของใคร
ก. Thomson ข. Millikan ค. Rutherford ง. Thomson และ Millikan
8.ความแตกต่างระหว่างงแบบจำลองอะตอมของทอมสันและรัทเทอรฟ์อรด์คือข้อใด
ก. ชนิดของอนุภาคที่อยู่ในอะตอม
ข. ตำแหน่งของอนุภาคที่อยู่ในอะตอม
ค. จำนวนอนุภาคที่อยู่ในอะตอม
ง. ขนาดของอนุภาคที่่อยู่ในอะตอม
9.ผลการทดลองของรัทเทอรฟ์อรด์ในข้อใดที่ไม่ส้อดคล้องกับเเบบจำลองอะตอมของทอมสัน
ก. อนุภาคแอลฟาผ่านทะลุเเผ่นทองคำมีลักษณะเป็นเส้นตรง
ข. อนุภาคแอลฟาผ่านทะลุเเผ่นทองคำไปได้ทีการเบี่ยงเบน
ค. อนุภาคแอลฟาวิ่งชนเเผ่นทองคำเเล้วสะส้อนกลับ
ง. อนุภาคแอลฟาบางอนุภาคถูกดูดกลืน
10.ค่า e/m ของไอออนบวกชนิดใดมีค่ามากที่สุด
ก. Li (A = 7) ข. Na (A = 24) ค. K (A = 39) ง. Ca (A = 40)
กำหนดให้ธาตุ A, B, C และ D มีเลขอะตอมเท่ากับ 55, 38, 35 และ10 ตามลำดับ
11..ธาตุใดมีพลังงานไอออไนเซชันลำดับที่ 1 ต่ำที่สุด
ก. A ข. B ค. C ง. D
12.ธาตุ P มีเลขอะตอม 15 มีนิวตรอน 16 จะมีเลขมวล โปรตอน และอิเล็กตรอนเท่าไรตามลำดับ
ก. 31, 15, 15 ข. 31, 16, 15 ค. 16, 15, 15 ง. 15, 31, 16
13.ข้อใดอธิบายความหมายไอโซโทปของธาตุได้ถูกต้อง
ก. ธาตุชนิดเดียวกัน เลขมวลเหมือนกันแต่เลขอะตอมต่างกัน
ข. ธาตุชนิดเดียวกันมีประจุในนิวเคลียสเหมือนกันแต่เลขมวลต่างกัน
ค. ธาตุต่างชนิดกันมีเลขอะตอมเหมือนกันแต่เลขมวลต่างกัน
ง. ธาตุต่างชนิดกันมีประจุในนิวเคลียสเหมือนกันแต่เลขมวลต่างกัน
14.ธาตุโซเดียม (Na) มีเลขอะตอมเท่ากับ 11 จะมีการจัดเรียงอิเล็กตรอนดังข้อใด
ก. 2, 9 ข. 2, 8, 1 ค. 2, 6, 5 ง. 1, 8, 2
15.ข้อใดบอกความหมายของเลขมวลได้ถูกต้อง
ก. จำนวนโปรตอนในนิวเคลียสของอะตอม
ข. มวลรวมของนิวตรอนโปรตอน และอิเล็กตรอนในอะตอม
ค. มวลรวมของนิวตรอนและโปรตอนในนิวเคลียสของอะตอม
ง. มวลรวมของโปรตอน และอิเล็กตรอนในนิวเคลียสของอะตอม
16.ธาตุคลอรีน (CI) มีเลขอะตอม 17 จะอยู่ในคาบและหมู่ละที่เท่าไรของตารางธาตุ
ก. คาบ 3 หมู่ 7 ข. คาบ 7 หมู่ 3 ค. คาบ 2 หมู่ 7 ง. คาบ 3 หมู่ 8
17.ไอออนของธาตุ X มีจำนวนโปรตอนนิวตรอนและอิเล็กตรอนเท่ากับ 9 10 10 ตามลำดับธาตุ X มีสัญลักษณ์เป็นไปตามข้อใด
ก.ธาตุ X มีเลขมวลเท่ากับ 19 และมีเลขอะตอมเท่ากับ 9
ข. X มีเลขมวลเท่ากับ 21 และมีเลขอะตอมเท่ากับ 9
ค.ธาตุ X มีเลขมวลเท่ากับ 21 และมีเลขอะตอมเท่ากับ 11
ง.ธาตุ X มีเลขมวลเท่ากับ 21 และมีเลขอะตอมเท่ากับ
18.สารบริสุทธิ์ของธาตุ X ในข้อที่ 69 มีสูตรโมเลกุลตามข้อใด
ก. F2 ข.Cl2 ค.N2 ง.O2
19.ข้อใดกล่าวไม่ถูกต้องเกี่ยวกับสมบัติของธาตุ X ในข้อที่ 69
ก. สาร X มีสถานะเป็นแก๊ส
ข. ไอออนที่เสถียรของธาตุ X มีประจุเป็น -1
ค. ธาตุ X พบได้ในบางส่วนของร่างกายคน
ง.ธาตุ X กับธาตุ Ca เกิดเป็นสารประกอบที่มีสูตร CaX
20.การจัดเรียงอิเล็กตรอนของไอออน X2+ ที่มี 44 โปรตอนเป็นตามข้อใด
ก. [Ar] 3d10 4s2 4p5 4d5
ข. [Ar] 3d10 4s2 4p6 4d2
ค. [Ar] 3d10 4s2 4p6 4d6
ง. [Ar] 3d10 4s2 4p6 4d8
เฉลย
1. ข 2. ค 3. ง 4. ข 5. ข 6. ง 7. ง 8. ง 9. ค 10. ก
11. ก 12. ก 13.ข 14. ข 15. ค 16.ก 17.ก 18.ก 19. ง 20. ค
เลขอะตอม (Atomic number) หมายถึง ตัวเลขที่แสดงถึงผลรวมจำนวนโปรตอนในอะตอมของธาตุ ซึ่งมีค่าเท่ากับจำนวนอิเล็กตรอน บางครั้งใช้สัญลักษณ์ Z
บอกได้ว่า ธาตุ P มีเลขอะตอม 15 ( โปรตอน = 15, อิเล็กตรอน = 15 )
===> P = 15 , e = 15 , n = 16
===> P = 19 , e = 19 , n = 20
===> P = 92 , e = 92 , n = 143
โปรเตียม
ดิวทีเรียม
(Heavy water)
ตริเตียม
กับ
เป็นไอโซบาร์กัน
กับ
เป็นไอโซบาร์กัน
กับ
เป็นไอโซโทนกัน (มีนิวตรอน = 20)
กับ
เป็นไอโซโทนกัน (มีนิวตรอน = 20)












ไม่มีความคิดเห็น:
แสดงความคิดเห็น